alleen voor onderzoeksdoeleinden
SRT1720 HCl Sirtuin activator
Cat.nr.S1129
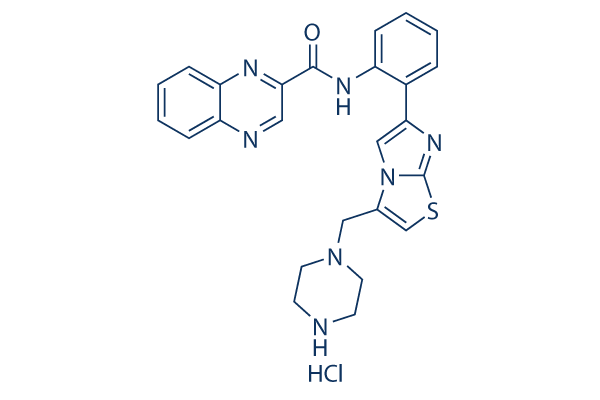
Chemische structuur
Molecuulgewicht: 506.02
Kwaliteitscontrole
Producten die vaak samen worden gebruikt met SRT1720 HCl
| Gerelateerde doelwitten | HDAC JAK BET Histone Methyltransferase PKC PARP HIF PRMT EZH2 AMPK |
|---|---|
| Overig Sirtuin Inhibitoren | Sirtinol Fisetin 3-TYP AGK2 SRT2104 (GSK2245840) OSS_128167 SirReal2 Thiomyristoyl NRD167 SRT2183 |
Celkweek, behandeling & werkzame concentratie
| Cellijnen | Assaytype | Concentratie | Incubatietijd | Formulering | Activiteitsbeschrijving | PMID |
|---|---|---|---|---|---|---|
| CACs | Function Assay | 4 μM | 30 min | DMSO | induces acute SIRT1 activation | 26254104 |
| MC3T3-E1 | Function Assay | 10 µM | 1 h | reduces the TGF-β-stimulated VEGF release in dose- and time-dependent manner | 26136978 | |
| MC3T3-E1 | Function Assay | 10 µM | 12 h | reduces the VEGF mRNA expression levels stimulated by TGF-β | 26136978 | |
| MC3T3-E1 | Function Assay | 20 μM | 1 h | suppresses the TGF-β-induced phosphorylation of p44/p42 MAP kinase or SAPK/JNK | 26136978 | |
| WE-68 | Apoptosis Assay | 0-24 μM | 24 h | induces cell death in dose dependently | 26055805 | |
| SK-ES-1 | Apoptosis Assay | 0-10 μM | 24 h | induces cell death in dose dependently | 26055805 | |
| SK-N-MC | Apoptosis Assay | 0-2.5 μM | 24 h | induces cell death in dose dependently | 26055805 | |
| WE-68 | Function Assay | 20 μM | 0-24 h | activates caspase 3/7 | 26055805 | |
| SK-ES-1 | Function Assay | 10 μM | 0-24 h | activates caspase 3/7 | 26055805 | |
| SK-N-MC | Function Assay | 3 μM | 0-24 h | activates caspase 3/7 | 26055805 | |
| NRK-49F | Function Assay | 0–2 μM | 36 h | increases expression of α-SMA and fibronectin dose dependently | 26022003 | |
| NRK-49F | Function Assay | 0–2 μM | 36 h | enhances phosphorylation of EGFR and PDGFRβ | 26022003 | |
| NRK-49F | Function Assay | 0–2 μM | 36 h | enhances STAT3 phosphorylation | 26022003 | |
| RAW264.7 | Function Assay | 1 μM | 6 h | upregulates the reduced SIRT1 protein or mRNA levels by high glucose | 25793995 | |
| MCF10A | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| MCF-7 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| T47D | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| SKBR3 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| MDA-MB-231 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| SUM149 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| HS578T | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| BT20 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| A459 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| HCT116 | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| Neu | Growth Inhibition Assay | 0-20 μM | 24 h | reduces cell viability dose dependently | 25411356 | |
| MDA-MB-231 | Function Assay | 5 μM | 8 h | increases the number of acidic vesicular organelles | 25411356 | |
| MDA-MB-231 | Function Assay | 5 μM | 16 h | induces lysosomal membrane permeabilization | 25411356 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | suppresses the FGF-2-stimulated osteoprotegerin release | 25290095 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | attenuates the FGF-2-induced osteoprotegerin mRNA expression | 25290095 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | attenuates the FGF-2-induced osteoprotegerin mRNA expression | 25290095 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | suppresses the BMP-4-stimulated VEGF release | 24435444 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | suppresses the PGF2α-stimulated OPG release | 24333336 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | reduces the PGF2α-stimulated phosphorylation of p44/p42 MAP kinase | 24333336 | |
| MC3T3-E1 | Function Assay | 10 μM | 60 min | attenuates the PGF2α-induced phosphorylation of both MEK1/2 and Raf-1 | 24333336 | |
| RPE | Cell Viability Assay | 5 µM | 1 h | attenuates OAβ-induced decrease of cell viability | 24036938 | |
| 9607 | Cell Viability Assay | 1 μM | 36 h | increases the cell viability compared with melatonin alone | 23726949 | |
| 9607 | Function Assay | 1 μM | 36 h | increases SIRT1 and decreased acetylated-p53 expression | 23726949 | |
| RPMI.8226 | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| U266 | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| MM.1S | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| KMS12 | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| LR5 | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| MM.1R | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| Ina6 | Cell Viability Assay | 7/10 μM | 24 h | decreases viability concentration dependently | 21950728 | |
| RPMI-8226 | Apoptosis Assay | 7/10 μM | 24 h | induces a significant increase in the Annexin V+/PI− apoptosis | 21950728 | |
| MM.1R | Apoptosis Assay | 7/10 μM | 24 h | induces a significant increase in the Annexin V+/PI− apoptosis | 21950728 | |
| H411EC3 | Function Assay | 50/100 nM | 6 h | increases SIRT1 activity in the presence of TSA, PEPCK activity, mRNA levels of Pck1 and Pgc1α, and elevating glucose production | 21212096 | |
| hepatocytes | Function Assay | 10 nM | 6 h | increases SIRT1 activity in the presence of TSA, PEPCK activity, mRNA levels of Pck1 and Pgc1α, and elevating glucose production | 21212096 | |
| hepatocytes | Function Assay | 10 nM | 6 h | increases Hmgcr and Acc gene expression | 21212096 | |
| U2OS | Function assay | 0.10 uM | Activation of SIRT1 in human U2OS cells assessed as decrease in p53 deacetylation level at 0.10 uM | 18046409 | ||
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| DAOY | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for DAOY cells | 29435139 | |||
| BT-37 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-37 cells | 29435139 | |||
| RD | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for RD cells | 29435139 | |||
| MG 63 (6-TG R) | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for MG 63 (6-TG R) cells | 29435139 | |||
| NB1643 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB1643 cells | 29435139 | |||
| OHS-50 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for OHS-50 cells | 29435139 | |||
| Rh41 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh41 cells | 29435139 | |||
| Rh30 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh30 cells | 29435139 | |||
| LAN-5 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for LAN-5 cells | 29435139 | |||
| Rh18 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh18 cells | 29435139 | |||
| Klik om meer experimentele gegevens over cellijnen te bekijken | ||||||
Chemische informatie, opslag en stabiliteit
| Molecuulgewicht | 506.02 | Formule | C25H23N7OS.HCl |
Opslag (vanaf de datum van ontvangst) | |
|---|---|---|---|---|---|
| CAS-nr. | 1001645-58-4 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | N/A | Smiles | C1CN(CCN1)CC2=CSC3=NC(=CN23)C4=CC=CC=C4NC(=O)C5=NC6=CC=CC=C6N=C5.Cl | ||
Oplosbaarheid
|
In vitro |
DMSO
: 100 mg/mL
(197.62 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo formulatiecalculator (heldere oplossing)
Stap 1: Voer onderstaande informatie in (Aanbevolen: een extra dier om rekening te houden met verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in de sectie oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-moedervloeistof: mg geneesmiddel vooropgelost in μL DMSO ( Concentratie moedervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de batch van het geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toeμL PEG300, mengen en verhelderen, daarna toevoegenμL Tween 80, mengen en verhelderen, daarna toevoegen μL ddH2O, mengen en verhelderen.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toe μL Maïsolie, mengen en verhelderen.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysieke methoden zoals vortexen, ultrasoon of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
SIRT1
(Cell-free assay) 0.16 μM(EC50)
|
|---|---|
| In vitro |
De maximale activeringsverhouding van SRT1720 versus de dichtstbijzijnde sirtuin-homologen, SIRT2 (EC1.5 = 37 μM) en SIRT3 (EC1.5 > 300 μM), bedraagt tot 781%. SRT1720 bindt aan het SIRT1 enzym-peptide substraatcomplex op een allosterische plaats amino-terminaal van het katalytische domein en verlaagt de Michaelis-constante voor geacetyleerde substraten. SRT1720 zou de nuchtere glucosewaarden kunnen verlagen. SRT1720 heeft geen effect op de nuchtere glucose bij muizen die met standaardvoer werden gevoed, wat aantoont dat farmacologische SIRT1-activering waarschijnlijk geen hypoglykemie zal veroorzaken. SRT1720 vermindert de hyperinsulinemie significant na 4 weken, waardoor de verhoogde insulinespiegels gedeeltelijk worden genormaliseerd. De behandeling met SRT1720 verhoogt de mitochondriale capaciteit met 15% in de gastrocnemiusspier, gemeten aan de hand van de citraatsynthaseactiviteit. Hogere concentraties SRT1720 (15 μM) veroorzaken een bescheiden (10-20%) afname van de normale cellevensvatbaarheid. SRT1720 remt ook significant VEGF-afhankelijke MM-celmigratie. |
| Kinase Assay |
SIRT1 fluorescentiepolarisatie-assay
|
|
In de SIRT1 FP-assay wordt de SIRT1-activiteit gemonitord met behulp van een 20-aminozuurpeptide (Ac-Glu-Glu-Lys(biotine)-Gly-Gln-Ser-Thr-Ser-Ser-His-Ser-Lys(Ac)-Nle-Ser-Thr-Glu-Gly–Lys(MR121 of Tamra)-Glu-Glu-NH2) afgeleid van de sequentie van p53. Het peptide is N-terminaal gekoppeld aan biotine en C-terminaal gemodificeerd met een fluorescerende tag. De reactie voor het monitoren van enzymactiviteit is een gekoppelde enzymassay waarbij de eerste reactie de deacetyleringsreactie is die door SIRT1 wordt gekatalyseerd en de tweede reactie de splitsing door trypsine is bij het nieuw blootgestelde lysine-residu. De reactie wordt gestopt en streptavidine wordt toegevoegd om de massaverschillen tussen substraat en product te accentueren. De gevoeligheid van de FP-assay maakt de identificatie van SRT1720 mogelijk. De reactiecondities voor fluorescentiepolarisatie zijn als volgt: 0,5 μM peptide substraat, 150 μM βNAD+, 0-10 nM SIRT1, 25 mM Tris-acetaat pH 8, 137 mM Na-Ac, 2,7 mM K-Ac, 1 mM Mg-Ac, 0,05% Tween-20, 0,1% Pluronic F127, 10 mM CaCl 2, 5 mM DTT, 0,025% BSA en 0,15 mM nicotinamide. De reactie wordt geïncubeerd bij 37 °C en gestopt door toevoeging van nicotinamide, en trypsine wordt toegevoegd om het gedeacetyleerde substraat te splitsen. Deze reactie wordt geïncubeerd bij 37 °C in aanwezigheid van 1 μM streptavidine. Fluorescerende polarisatie wordt bepaald bij excitatie (650 nm) en emissie (680 nm) golflengten.
|
|
| In vivo |
Bij DIO-muizen bootst SRT1720 verschillende effecten na die werden waargenomen na calorierestrictie, waaronder verbeterde insulinegevoeligheid, genormaliseerde glucose- en insulinespiegels en verhoogde mitochondriale capaciteit. Bovendien verbetert SRT1720 bij dieet-geïnduceerde obese en genetisch obese muizen de insulinegevoeligheid, verlaagt het de plasma glucose en verhoogt het de mitochondriale capaciteit. SRT1720 is dus een veelbelovend nieuw therapeutisch middel voor de behandeling van verouderingsziekten zoals type 2 diabetes. In overeenstemming met een verbeterde glucosetolerantie, is de glucose-infusiesnelheid die nodig is om euglykemie te handhaven ongeveer 35% hoger bij met SRT1720 behandelde fa/fa ratten, en de totale glucoseafvoersnelheid is met ongeveer 20% verhoogd. SRT1720 voorkomt ook de groei van multiple myeloomtumoren. |
Referenties |
|
Toepassingen
| Methoden | Biomarkers | Afbeeldingen | PMID |
|---|---|---|---|
| Western blot | Cleaved-PARP-1 / Cleaved-caspase-3 / LC3-II / p62 / SIRT1 |
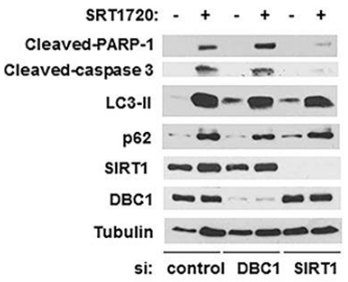
|
26655844 |
| Immunofluorescence | Cathepsin B |
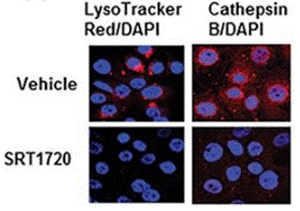
|
26655844 |
| Growth inhibition assay | Cell viability |

|
25411356 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, laat dan een bericht achter.
Veelgestelde vragen
Vraag 1:
How can we prepare it for in vivo mouse studies?
Antwoord:
It can be dissolved in 30% PEG 400+0.5% Tween 80+5% Propylene glycol at 30mg/ml as a suspension, which is fine for oral gavage. We’ve also found that it can be dissolved in 2% DMSO+30% PEG 300+1% Tween 80+ddH2O at 3mg/ml clearly, making it suitable for injection. When preparing the solution, please dissolve the compound in DMSO clearly first, then add PEG and Tween. After they are mixed well, dilute with water.
