alleen voor onderzoeksdoeleinden
Dovitinib (TKI-258) FLT3 remmer
Cat.nr.S1018
Chemische structuur
Molecuulgewicht: 392.43
Kwaliteitscontrole
| Gerelateerde doelwitten | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Overig FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI258) Lactate monohydrate Tandutinib (MLN518) KW-2449 ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Celkweek, behandeling & werkzame concentratie
| Cellijnen | Assaytype | Concentratie | Incubatietijd | Formulering | Activiteitsbeschrijving | PMID |
|---|---|---|---|---|---|---|
| SupB15 | Growth Inhibition Assay | IC50=0.449 μM | 25202073 | |||
| SupB15-R | Growth Inhibition Assay | IC50=0.558 μM | 25202073 | |||
| BaF3-pSRα | Growth Inhibition Assay | IC50=0.668 μM | 25202073 | |||
| BaF3-p210Bcr-Abl | Growth Inhibition Assay | IC50=0.692 μM | 25202073 | |||
| BaF3-p210Bcr-Abl-T315I | Growth Inhibition Assay | IC50=2.626 μM | 25202073 | |||
| CCRF-CEM | Growth Inhibition Assay | IC50=0.398 μM | 25202072 | |||
| CEM/C2 | Growth Inhibition Assay | IC50=1.125 μM | 25202072 | |||
| Nalm-6 | Growth Inhibition Assay | IC50=0.382 μM | 25202072 | |||
| SEM-K2 | Growth Inhibition Assay | IC50=0.022 μM | 25202072 | |||
| HB-1119 | Growth Inhibition Assay | IC50=0.028 μM | 25202072 | |||
| RS4:11 | Growth Inhibition Assay | IC50=2.81 μM | 25202072 | |||
| Nalm-6 | Apoptosis Assay | 2 μM | 24/48 h | induces apoptosis resulting in about 72% of cell death after 24 h treatment and 81% after 48 h | 25202072 | |
| SEM-K2 | Apoptosis Assay | 0.1/1 μM | 24 h | induces early apoptosis of SEM-K2 cells at 0.1 μM after 24 h | 25202072 | |
| HCT-116 | Growth Inhibition Assay | IC50=3.050.58 μM | 24495750 | |||
| HT-29 | Growth Inhibition Assay | IC50=5.21.93 μM | 24495750 | |||
| SW-480 | Growth Inhibition Assay | IC50=4.330.47 μM | 24495750 | |||
| CaCO2 | Growth Inhibition Assay | IC50=3.230.64 μM | 24495750 | |||
| LS174T | Growth Inhibition Assay | IC50=4.330.47 μM | 24495750 | |||
| HEC-1A | Function Assay | 0.05/0.1/0.5 μM | 72 h | causes a decrease in STAT3, ERK, and AKT phosphorylation | 24495750 | |
| AN3CA | Function Assay | 0.05/0.1/0.5 μM | 72 h | causes a decrease in STAT3, ERK, and AKT phosphorylation | 24495750 | |
| MFE-296 | Function Assay | 0.05/0.1/0.5 μM | 72 h | causes a decrease in STAT3, ERK, and AKT phosphorylation | 24495750 | |
| UMC3 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| 5637 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| HU456 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| MGHU4 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| HT1376 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| RT112 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| T24 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| BFTC905 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| TCC-SUP | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| RT4 | Cell Viability Assay | 1-10 μM | 72 h | inhibits cell growth in a dose dependent manner | 24325461 | |
| HONE1 | Growth Inhibition Assay | 0.1-10 μM | 48 h | induces G2/M delay in a concentration-dependent manner | 24238094 | |
| HNE1 | Growth Inhibition Assay | 0.1-10 μM | 48 h | induces G2/M delay in a concentration-dependent manner | 24238094 | |
| CNE2 | Growth Inhibition Assay | 0.1-10 μM | 48 h | induces G2/M delay in a concentration-dependent manner | 24238094 | |
| C666-1 | Growth Inhibition Assay | 0.1-10 μM | 48 h | induces G2/M delay in a concentration-dependent manner | 24238094 | |
| HeLa | Growth Inhibition Assay | 0.1-10 μM | 24 h | induces G2/M arrest in a concentration-dependent manner | 24238094 | |
| Hep3B | Growth Inhibition Assay | 0.1-10 μM | 24 h | induces G2 arrest | 24238094 | |
| HepG2 | Growth Inhibition Assay | 48 h | IC50=2.727 ± 0.429 μM | 23546591 | ||
| Hep3B | Growth Inhibition Assay | 48 h | IC50=4.223 ± 0.839 μM | 23546591 | ||
| PLC/PRF5 | Growth Inhibition Assay | 48 h | IC50=16.120 ± 4.001 μM | 23546591 | ||
| Huh7 | Growth Inhibition Assay | 48 h | IC50=15.007 ± 7.334 μM | 23546591 | ||
| HepG2 | Growth Inhibition Assay | 72 h | IC50=1.200 ± 0.226 μM | 23546591 | ||
| Hep3B | Growth Inhibition Assay | 72 h | IC50=0.892 ± 0.044 μM | 23546591 | ||
| PLC/PRF5 | Growth Inhibition Assay | 72 h | IC50=3.110 ± 0.337 μM | 23546591 | ||
| Huh7 | Growth Inhibition Assay | 72 h | IC50=3.980 ± 0.803 μM | 23546591 | ||
| MFE280 | Growth Inhibition Assay | IC50=0.42 ± 0.06 μM | 23443805 | |||
| AN3CA | Growth Inhibition Assay | IC50=0.50 ± 0.10 μM | 23443805 | |||
| HEC155 | Growth Inhibition Assay | IC50=0.66 ± 0.09 μM | 23443805 | |||
| MFE296 | Growth Inhibition Assay | IC50=0.66 ± 0.19 μM | 23443805 | |||
| SPAC1S | Growth Inhibition Assay | IC50=0.77 ± 0.08 μM | 23443805 | |||
| RL952 | Growth Inhibition Assay | IC50=0.93 ± 0.01 μM | 23443805 | |||
| EN1 | Growth Inhibition Assay | IC50=1.02 ± 0.25 μM | 23443805 | |||
| SNGII | Growth Inhibition Assay | IC50=1.24 ± 0.28 μM | 23443805 | |||
| ISHIKAWA | Growth Inhibition Assay | IC50=1.30 ± 0.11 μM | 23443805 | |||
| HEC1A | Growth Inhibition Assay | IC50=1.34 ± 0.30 μM | 23443805 | |||
| KLE | Growth Inhibition Assay | IC50=1.37 ± 0.02 μM | 23443805 | |||
| SNGM | Growth Inhibition Assay | IC50=1.42 ± 0.13 μM | 23443805 | |||
| USPC2 | Growth Inhibition Assay | IC50=1.62 ± 0.01 μM | 23443805 | |||
| EN | Growth Inhibition Assay | IC50=1.66 ± 0.01 μM | 23443805 | |||
| MFE319 | Growth Inhibition Assay | IC50=1.87 ± 0.45 μM | 23443805 | |||
| EFE184 | Growth Inhibition Assay | IC50=2.04 ± 0.13 μM | 23443805 | |||
| ECC1 | Growth Inhibition Assay | IC50=2.07 ± 0.01 μM | 23443805 | |||
| HEC1B | Growth Inhibition Assay | IC50=2.57 ± 0.23 μM | 23443805 | |||
| USPC1 | Growth Inhibition Assay | IC50=2.60 ± 0.13 μM | 23443805 | |||
| SPAC1L | Growth Inhibition Assay | IC50=3.06 ± 1.14 μM | 23443805 | |||
| HUVEC | Cell Viability Assay | 0-25 μM | 72 h | DMSO | inhibits cell growth in a dose dependent manner | 23228017 |
| HMVEC | Cell Viability Assay | 0-25 μM | 72 h | DMSO | inhibits cell growth in a dose dependent manner | 23228017 |
| MHCC-97H | Cell Viability Assay | 0-25 μM | 72 h | DMSO | inhibits cell growth in a dose dependent manner | 23228017 |
| SMMC7721 | Cell Viability Assay | 0-25 μM | 72 h | DMSO | inhibits cell growth in a dose dependent manner | 23228017 |
| Huh-7 | Apoptosis Assay | 0-12.5 μM | 24 h | DMSO | sensitizes HCC cells to TRAIL- and tigatuzumab-induced apoptosis in a dose-dependent manner | 22230479 |
| Sk-Hep1 | Apoptosis Assay | 0-12.5 μM | 24 h | DMSO | sensitizes HCC cells to TRAIL- and tigatuzumab-induced apoptosis in a dose-dependent manner | 22230479 |
| Hep3B | Apoptosis Assay | 0-12.5 μM | 24 h | DMSO | sensitizes HCC cells to TRAIL- and tigatuzumab-induced apoptosis in a dose-dependent manner | 22230479 |
| PLC5 | Apoptosis Assay | 0-12.5 μM | 24 h | DMSO | sensitizes HCC cells to TRAIL- and tigatuzumab-induced apoptosis in a dose-dependent manner | 22230479 |
| PLC5 | Cell Viability Assay | 0-15 μM | 72 h | reduces cell viability in a dose-dependent manner | 22180308 | |
| Hep3B | Cell Viability Assay | 0-15 μM | 72 h | reduces cell viability in a dose-dependent manner | 22180308 | |
| Sk-Hep1 | Cell Viability Assay | 0-15 μM | 72 h | reduces cell viability in a dose-dependent manner | 22180308 | |
| Huh-7 | Cell Viability Assay | 0-15 μM | 72 h | reduces cell viability in a dose-dependent manner | 22180308 | |
| PLC5 | Apoptosis Assay | 0-15 μM | 24 h | increases apoptotic cell death in a dose-dependent manner | 22180308 | |
| Hep3B | Apoptosis Assay | 0-15 μM | 24 h | increases apoptotic cell death in a dose-dependent manner | 22180308 | |
| Sk-Hep1 | Apoptosis Assay | 0-15 μM | 24 h | increases apoptotic cell death in a dose-dependent manner | 22180308 | |
| Huh-7 | Apoptosis Assay | 0-15 μM | 24 h | increases apoptotic cell death in a dose-dependent manner | 22180308 | |
| PLC5 | Function Assay | 0-10 μM | 24 h | causes dose-dependent DNA fragmentation | 22180308 | |
| Hep3B | Function Assay | 0-10 μM | 24 h | causes dose-dependent DNA fragmentation | 22180308 | |
| Sk-Hep1 | Function Assay | 0-10 μM | 24 h | causes dose-dependent DNA fragmentation | 22180308 | |
| Huh-7 | Function Assay | 0-10 μM | 24 h | causes dose-dependent DNA fragmentation | 22180308 | |
| SW780 | Growth Inhibition Assay | 5 d | IC50=50 nM | 21119661 | ||
| RT112 | Growth Inhibition Assay | 5 d | IC50=15 nM | 21119661 | ||
| RT4 | Growth Inhibition Assay | 5 d | IC50=5 nM | 21119661 | ||
| JMSU1 | Growth Inhibition Assay | 5 d | IC50=50 nM | 21119661 | ||
| J82 | Growth Inhibition Assay | 5 d | IC50=1400 nM | 21119661 | ||
| 97-7 | Growth Inhibition Assay | 5 d | IC50=1000 nM | 21119661 | ||
| RT112 | Function Assay | 500 nM | 24 h | increases the proportion of cells in G1 accompanied by a decrease in S and G2/M phases | 21119661 | |
| RT4 | Function Assay | 500 nM | 24 h | increases the proportion of cells in G1 accompanied by a decrease in S and G2/M phases | 21119661 | |
| MGH-U3 | Function Assay | 500 nM | 24 h | increases the proportion of cells in G1 accompanied by a decrease in S and G2/M phases | 21119661 | |
| SW780 | Function Assay | 500 nM | 24 h | increases the proportion of cells in G1 accompanied by a decrease in S and G2/M phases | 21119661 | |
| 97-7 | Function Assay | 500 nM | 24 h | increases the proportion of cells in G1 accompanied by a decrease in S and G2/M phases | 21119661 | |
| J807C | Cell Viability Assay | 0-400 nM | 48 h | inhibits cell growth in a dose dependent manner | 15598814 | |
| Y373C | Cell Viability Assay | 0-400 nM | 48 h | inhibits cell growth in a dose dependent manner | 15598814 | |
| K650E | Cell Viability Assay | 0-400 nM | 48 h | inhibits cell growth in a dose dependent manner | 15598814 | |
| G384D | Cell Viability Assay | 0-400 nM | 48 h | inhibits cell growth in a dose dependent manner | 15598814 | |
| F384L | Cell Viability Assay | 0-400 nM | 48 h | inhibits cell growth in a dose dependent manner | 15598814 | |
| KMS11 | Growth Inhibition Assay | 72 h | IC50=90 nM | 15598814 | ||
| KMS18 | Growth Inhibition Assay | 72 h | IC50=550 nM | 15598814 | ||
| OPM2 | Growth Inhibition Assay | 72 h | IC50=90 nM | 15598814 | ||
| H929 | Growth Inhibition Assay | 72 h | IC50> 2500 nM | 15598814 | ||
| 8226 | Growth Inhibition Assay | 72 h | IC50> 2500 nM | 15598814 | ||
| U266 | Growth Inhibition Assay | 72 h | IC50> 2500 nM | 15598814 | ||
| KM12L4A | Function assay | Inhibition of VEGFR2 phosphorylation expressed in human KM12L4A cells by Western blot analysis, EC50=0.046μM | 19113866 | |||
| KM12L4A | Function assay | Inhibition of PDGFRbeta phosphorylation expressed in human KM12L4A cells Western blot analysis, EC50=0.051μM | 19113866 | |||
| KM12L4A | Function assay | Inhibition of FGFR1 phosphorylation expressed in human KM12L4A cells by Western blot analysis, EC50=0.166μM | 19113866 | |||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant PDGFRbeta (unknown origin) expressed in baculovirus infected insect cells using biotinylated peptide substrate GGLFDDPSYVNVQNL in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescence assay, IC50=0.001μM | 27914362 | ||
| Sf9 | Function assay | 1 to 4 hrs | Inhibition of recombinant human N-terminal GST/His6-tagged c-KIT (544 to 976 residues) expressed in baculovirus infected sf9 cells using biotinylated peptide substrate GGLFDDPSYVNVQNL in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescen, IC50=0.001μM | 27914362 | ||
| Sf9 | Function assay | 1 to 4 hrs | Inhibition of recombinant human N-terminal GST/His6-tagged FLT3 (571 to 993 residues) expressed in baculovirus infected sf9 cells using biotinylated peptide substrate GGLFDDPSYVNVQNL in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescenc, IC50=0.001μM | 27914362 | ||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant FGFR1 (unknown origin) expressed in baculovirus infected insect cells using biotinylated peptide substrate GGGGQDGKDYIVLPI in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescence assay, IC50=0.008μM | 27914362 | ||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant VEGFR3 (unknown origin) expressed in baculovirus infected insect cells using biotinylated peptide substrate GGGGQDGKDYIVLPI in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescence assay, IC50=0.008μM | 27914362 | ||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant VEGFR1 (unknown origin) expressed in baculovirus infected insect cells using biotinylated peptide substrate GGGGQDGKDYIVLPI in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescence assay, IC50=0.01μM | 27914362 | ||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant VEGFR2 (unknown origin) expressed in baculovirus infected insect cells using biotinylated peptide substrate GGGGQDGKDYIVLPI in presence of ATP incubated for 1 to 4 hrs by time resolved fluorescence assay, IC50=0.013μM | 27914362 | ||
| TC32 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for TC32 cells | 29435139 | |||
| SJ-GBM2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SJ-GBM2 cells | 29435139 | |||
| A673 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for A673 cells | 29435139 | |||
| SK-N-MC | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-MC cells | 29435139 | |||
| BT-37 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-37 cells | 29435139 | |||
| NB-EBc1 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB-EBc1 cells | 29435139 | |||
| U-2 OS | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for U-2 OS cells | 29435139 | |||
| Saos-2 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Saos-2 cells | 29435139 | |||
| SK-N-SH | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for SK-N-SH cells | 29435139 | |||
| NB1643 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for NB1643 cells | 29435139 | |||
| LAN-5 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for LAN-5 cells | 29435139 | |||
| BT-12 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for BT-12 cells | 29435139 | |||
| Rh18 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for Rh18 cells | 29435139 | |||
| OHS-50 | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for OHS-50 cells | 29435139 | |||
| RD | qHTS assay | qHTS of pediatric cancer cell lines to identify multiple opportunities for drug repurposing: Primary screen for RD cells | 29435139 | |||
| insect cells | Function assay | 1 to 4 hrs | Inhibition of recombinant FGFR1 (unknown origin) expressed in baculovirus infected insect cells using GGGGQDGKDYIVLPI as substrate after 1 to 4 hrs by time-resolved fluorescence assay, IC50=0.008μM | 30503938 | ||
| NCI-H1703 | Function assay | 10 uM | 24 hrs | Inhibition of TNIK in human NCI-H1703 cells transfected with lentiviral vector 7TFP assessed as reduction of GSK3 inhibitor X activated TNIK-mediated Wnt/TCF/beta-catenin-dependent transcription at 10 uM after 24 hrs by luciferase reporter assay | ChEMBL | |
| LoVo | Cytotoxicity assay | 10 uM | 72 hrs | Cytotoxicity against Wnt/beta-catenin signalling dependent human LoVo cells assessed as cell viability at 10 uM after 72 hrs by ATPlite assay | ChEMBL | |
| HCT116 | Cytotoxicity assay | 10 uM | 72 hrs | Cytotoxicity against Wnt/beta-catenin signalling dependent human HCT116 cells assessed as cell viability at 10 uM after 72 hrs by ATPlite assay | ChEMBL | |
| Klik om meer experimentele gegevens over cellijnen te bekijken | ||||||
Chemische informatie, opslag en stabiliteit
| Molecuulgewicht | 392.43 | Formule | C21H21FN6O |
Opslag (vanaf de datum van ontvangst) | |
|---|---|---|---|---|---|
| CAS-nr. | 405169-16-6 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | CHIR-258 | Smiles | CN1CCN(CC1)C2=CC3=C(C=C2)N=C(N3)C4=C(C5=C(C=CC=C5F)NC4=O)N | ||
Oplosbaarheid
|
In vitro |
DMSO
: 30 mg/mL
(76.44 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo formulatiecalculator (heldere oplossing)
Stap 1: Voer onderstaande informatie in (Aanbevolen: een extra dier om rekening te houden met verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in de sectie oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-moedervloeistof: mg geneesmiddel vooropgelost in μL DMSO ( Concentratie moedervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de batch van het geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toeμL PEG300, mengen en verhelderen, daarna toevoegenμL Tween 80, mengen en verhelderen, daarna toevoegen μL ddH2O, mengen en verhelderen.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toe μL Maïsolie, mengen en verhelderen.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysieke methoden zoals vortexen, ultrasoon of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
FLT3
(Cell-free assay) 1 nM
c-Kit
(Cell-free assay) 2 nM
FGFR1
(Cell-free assay) 8 nM
VEGFR3/FLT4
(Cell-free assay) 8 nM
FGFR3
(Cell-free assay) 9 nM
VEGFR1/FLT1
(Cell-free assay) 10 nM
VEGFR2/Flk1
(Cell-free assay) 13 nM
PDGFRβ
(Cell-free assay) 27 nM
CSF-1R/c-Fms
(Cell-free assay) 36 nM
|
|---|---|
| In vitro |
Dovitinib (TKI-258) remt krachtig de FGF-gestimuleerde groei van WT- en F384L-FGFR3-expresserende B9-cellen met een IC50 van 25 nM. Bovendien remt het de proliferatie van B9-cellen die elk van de verschillende geactiveerde mutanten van FGFR3 tot expressie brengen. Interessant is dat er minimale verschillen worden waargenomen in de gevoeligheid van de verschillende FGFR3-mutaties voor deze verbinding, waarbij de IC50 varieert van 70 tot 90 nM voor elk van de verschillende mutaties. IL-6-afhankelijke B9-cellen die alleen vector bevatten (B9-MINV-cellen) zijn resistent tegen de remmende activiteit bij concentraties tot 1 µM. Het remt de celproliferatie van KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) en KMS18 (FGFR3-G384D) cellen met een IC50 van respectievelijk 90 nM (KMS11 en OPM2) en 550 nM. De verbinding remt FGF-gemedieerde ERK1/2-fosforylatie en induceert cytotoxiciteit in FGFR3-expresserende primaire MM-cellen. BMSCs verlenen een bescheiden mate van resistentie met 44,6% groeiremming voor cellen behandeld met 500 nM Dovitinib en gekweekt op stroma, vergeleken met 71,6% groeiremming voor cellen gekweekt zonder BMSCs. Het remt de proliferatie van M-NFS-60, een M-CSF-groeigedreven myeloblastische muizencellijn met een mediane effectieve concentratie (EC50) van 220 nM. Behandeling van SK-HEP1-cellen met deze verbinding resulteert in een dosisafhankelijke reductie in celgetal en G2/M-fasearrest met reductie in de G0/G1- en S-fasen, remming van verankeringonafhankelijke groei en blokkade van bFGF-geïnduceerde celmotiliteit. De IC50 hiervoor in SK-HEP1-cellen is ongeveer 1,7 µM. Het vermindert ook significant de basale fosforyleringsniveaus van FGFR-1, FGFR-substraat 2α (FRS2-α) en ERK1/2, maar niet Akt, in zowel SK-HEP1- als 21-0208-cellen. In 21-0208 HCC-cellen remt het significant de bFGF-geïnduceerde fosforylering van FGFR-1, FRS2-α, ERK1/2, maar niet Akt. |
| Kinase Assay |
In vitro kinase assays
|
|
De remmende concentratie van 50% (IC50) waarden voor de remming van RTK's door Dovitinib (TKI-258) worden bepaald in een tijdopgeloste fluorescentie (TRF) of radioactief formaat, waarbij de remming van de fosfaatoordracht naar een substraat door het respectievelijke enzym wordt gemeten. De kinase-domeinen van FGFR3, FGFR1, PDGFRβ en VEGFR1-3 worden getest in 50 mM HEPES (N-2-hydroxyethylpiperazine-N′-2-ethaansulfonzuur), pH 7.0, 2 mM MgCl2, 10 mM MnCl2, 1 mM NaF, 1 mM dithiothreitol (DTT), 1 mg/mL bovine serumalbumine (BSA), 0,25 μM gebiotinyleerd peptidesubstraat (GGGGQDGKDYIVLPI) en 1 tot 30 μM adenosine trifosfaat (ATP) afhankelijk van de Km voor het respectievelijke enzym. ATP-concentraties liggen op of net onder de Km. Voor c-KIT- en FLT3-reacties wordt de pH verhoogd tot 7.5 met 0,2 tot 8 μM ATP in aanwezigheid van 0,25 tot 1 μM gebiotinyleerd peptidesubstraat (GGLFDDPSYVNVQNL). Reacties worden 1 tot 4 uur bij kamertemperatuur geïncubeerd en het gefosforyleerde peptide wordt op streptavidine-gecoate microtiterplaten met stopreactiebuffer (25 mM EDTA [ethyleendiaminetetraazijnzuur], 50 mM HEPES, pH 7.5) vastgelegd. Gefosforyleerd peptide wordt gemeten met het DELFIA TRF-systeem met behulp van een europium-gelabeld antifosfotyrosine-antilichaam PT66. De concentratie van deze verbinding voor IC50 wordt berekend met behulp van niet-lineaire regressie met XL-Fit data-analyse software versie 4.1 (IDBS). Remming van colony-stimulating factor-1 receptor (CSF-1R), PDGFRα, insulin receptor (InsR) en insulin-like growth factor receptor 1 (IGFR1) kinase-activiteit wordt bepaald bij ATP-concentraties dicht bij de Km voor ATP.
|
|
| In vivo |
Dovitinib (TKI-258) induceert in vivo zowel cytostatische als cytotoxische reacties, resulterend in regressie van FGFR3-expresserende tumoren. Het vertoont een dosis- en blootstellingsafhankelijke remming van doelreceptortyrosinekinases (RTK's) die tot expressie komen in tumorxenografts. Deze verbinding remt krachtig de tumorgroei van zes HCC-lijnen. Remming van Angiogenesis correleerde met inactivatie van FGFR/PDGFRβ/VEGFR2-signaalroutes. In een orthotoop model remt het krachtig de primaire tumorgroei en longmetastase en verlengt het de overleving van muizen significant. Toediening van Dovitinib resulteert in significante tumorgroeiremming en tumorregressies, inclusief grote, gevestigde tumoren (500-1.000 mm3). |
Referenties |
|
Toepassingen
| Methoden | Biomarkers | Afbeeldingen | PMID |
|---|---|---|---|
| Western blot | CDK1 / p-CDK1 / p53 / p21 p-PDGFR-β / PDGFR-β / p-ERK / ERK p-VEGFR-2 / VEGFR-2 / p-FGFR-1 / FGFR-1 p-STAT3 / STAT3 / Mcl-1 / LC3 / Beclin 1 / p62 |
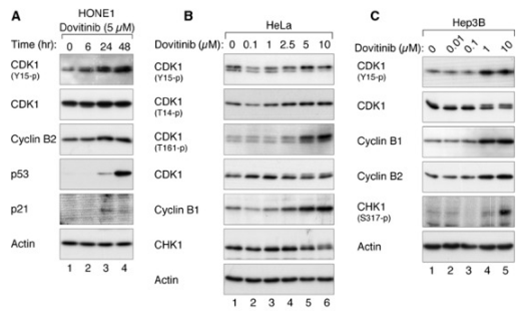
|
24238094 |
| Growth inhibition assay | Cell viability |
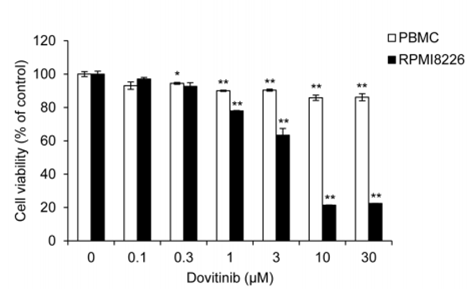
|
28467797 |
Informatie over klinische proeven
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Werving | Aandoeningen | Sponsor/medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT05571969 | Recruiting | Advanced Solid Tumors |
Allarity Therapeutics|Amarex Clinical Research |
February 20 2023 | Phase 1 |
| NCT02268435 | Withdrawn | Gastrointestinal Stromal Tumors |
Asan Medical Center |
March 2015 | Phase 1 |
| NCT01700270 | Completed | Advanced Solid Tumors Excluding Breast Cancer |
Novartis Pharmaceuticals|Novartis |
May 2013 | Phase 1 |
| NCT01680796 | Withdrawn | Multiple Myeloma |
University of Florida|Novartis Pharmaceuticals |
February 2013 | Phase 1 |
| NCT01266070 | Terminated | Von Hippel-Lindau Syndrome |
M.D. Anderson Cancer Center|Novartis |
November 2012 | Phase 2 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, laat dan een bericht achter.
