alleen voor onderzoeksdoeleinden
Crizotinib hydrochloride c-Met remmer
Cat.nr.S5190
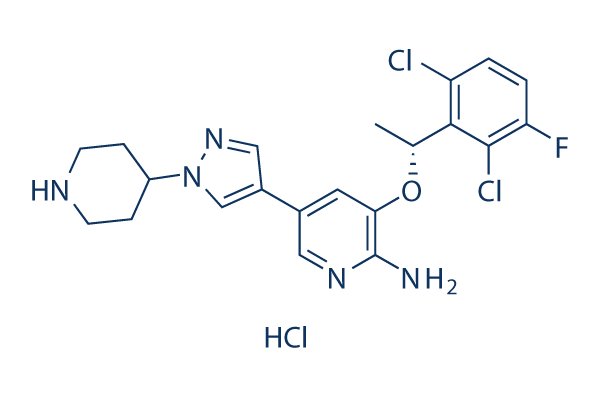
Chemische structuur
Molecuulgewicht: 486.8
Kwaliteitscontrole
| Gerelateerde doelwitten | EGFR VEGFR PDGFR FGFR Src MEK CSF-1R FLT3 HER2 c-Kit |
|---|---|
| Overig c-Met Inhibitoren | Tepotinib Dihexa SGX-523 PHA-665752 Foretinib SU11274 BMS-777607 JNJ-38877605 Tivantinib PF-04217903 |
Chemische informatie, opslag en stabiliteit
| Molecuulgewicht | 486.8 | Formule | C21H23Cl3FN5O |
Opslag (vanaf de datum van ontvangst) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-nr. | 1415560-69-8 | -- | Opslag van stamoplossingen |
|
|
| Synoniemen | Xalkori, PF-02341066 hydrochloride | Smiles | Cl.CC(OC1=C(N)N=CC(=C1)C2=C[N](N=C2)C3CCNCC3)C4=C(Cl)C=CC(=C4Cl)F | ||
Oplosbaarheid
|
In vitro |
DMSO
: 97 mg/mL
(199.26 mM)
Water : 97 mg/mL Ethanol : 97 mg/mL |
Molariteitscalculator
|
In vivo |
|||||
In vivo formulatiecalculator (heldere oplossing)
Stap 1: Voer onderstaande informatie in (Aanbevolen: een extra dier om rekening te houden met verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in de sectie oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-moedervloeistof: mg geneesmiddel vooropgelost in μL DMSO ( Concentratie moedervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de batch van het geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toeμL PEG300, mengen en verhelderen, daarna toevoegenμL Tween 80, mengen en verhelderen, daarna toevoegen μL ddH2O, mengen en verhelderen.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toe μL Maïsolie, mengen en verhelderen.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysieke methoden zoals vortexen, ultrasoon of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
ROS1
(Cell-free assay) <0.025 nM(Ki)
c-Met
(Cell-based assay) 11 nM
NPM-ALK
(Cell-based assay) 24 nM
|
|---|---|
| In vitro |
PF-2341066 vertoont een vergelijkbare potentie tegen c-Met-fosforylering in mIMCD3-muis- of MDCK-hondenepitheelcellen met IC50 van respectievelijk 5 nM en 20 nM. PF-2341066 vertoont verbeterde of vergelijkbare activiteit tegen NIH3T3-cellen die zijn gemanipuleerd om c-Met ATP-bindingsplaatsmutanten V1092I of H1094R of de P-loop-mutant M1250T tot expressie te brengen met IC50 van respectievelijk 19 nM, 2 nM en 15 nM, vergeleken met NIH3T3-cellen die de wildtype-receptor tot expressie brengen met IC50 van 13 nM. Daarentegen wordt een duidelijke verschuiving in potentie van PF-2341066 waargenomen tegen cellen die zijn gemanipuleerd om c-Met-activeringslusmutanten Y1230C en Y1235D tot expressie te brengen met IC50 van respectievelijk 127 nM en 92 nM, vergeleken met de wildtype-receptor. PF-2341066 voorkomt ook potent de fosforylering van c-Met in NCI-H69- en HOP92-cellen, met IC50 van respectievelijk 13 nM en 16 nM, die de endogene c-Met-varianten R988C en T1010I tot expressie brengen. PF-2341066 is >1.000-voudig selectief voor de VEGFR2- en PDGFRβ-RTK's, >250-voudig selectief voor IRK en Lck, en ~40- tot 60-voudig selectief voor Tie2, TrkA en TrkB, allemaal vergeleken met c-Met. PF-2341066 is 20- tot 30-voudig selectief voor RON- en Axl-RTK's. Daarentegen vertoont PF-2341066 een bijna-equivalente IC50 van 24 nM tegen de nucleofosmine (NPM)-anaplastic lymphoma kinase (ALK) oncogene fusievariant van de ALK RTK die tot expressie wordt gebracht door de KARPAS299 menselijke anaplastische grootcellige lymfoom (ALCL) cellijn. PF-2341066 remt c-Met-afhankelijke neoplastische fenotypes van kankercellen en angiogene fenotypes van endotheelcellen. PF-2341066 onderdrukt de groei van menselijke GTL-16 maagcarcinoomcellen met een IC50 van 9,7 nM. PF-2341066 induceert apoptose in GTL-16-cellen met een IC50 van 8,4 nM. PF-2341066 remt HGF-gestimuleerde migratie en invasie van menselijke NCI-H441 longcarcinoomcellen met IC50 van respectievelijk 11 nM en 6,1 nM. PF-2341066 remt MDCK-celverspreiding met een IC50 van 16 nM. PF-2341066 voorkomt HGF-gestimuleerde c-Met-fosforylering, celoverleving en Matrigel-invasie met IC50 van respectievelijk 11 nM, 14 nM en 35 nM. Bovendien voorkomt PF-2341066 serum-gestimuleerde HMVEC-vertakkende tubulogenese (vorming van vasculaire buisjes) in fibrinegels. |
| Kinase Assay |
Cellulaire kinasefosforylering ELISA-assays
|
|
Cellen worden gezaaid in 96-well platen in media aangevuld met 10% foetaal runderserum (FBS) en na 24 uur overgebracht naar serumvrije media [met 0,04% runderserumalbumine (BSA)]. In experimenten die ligandafhankelijke RTK-fosforylering onderzoeken, worden overeenkomstige groeifactoren gedurende maximaal 20 minuten toegevoegd. Na incubatie van cellen met PF-2341066 gedurende 1 uur en/of geschikte liganden gedurende de aangegeven tijden, worden de cellen eenmaal gewassen met HBSS aangevuld met 1 mM Na3VO4, en worden proteïnelysaten gegenereerd uit de cellen. Vervolgens wordt de fosforylering van geselecteerde Protein Tyrosine Kinase beoordeeld met een sandwich ELISA-methode met behulp van specifieke vangantistoffen die worden gebruikt om 96-well platen te coaten en een detectieantistof die specifiek is voor gefosforyleerde tyrosineresiduen. Met antistoffen gecoate platen worden (a) 's nachts bij 4°C geïncubeerd in aanwezigheid van proteïnelysaten; (b) zevenmaal gewassen in 1% Tween 20 in PBS; (c) gedurende 30 minuten geïncubeerd in een mierikswortelperoxidase-geconjugeerd anti-totaal-fosfotyrosine (PY-20) antistof (1:500); (d) opnieuw zevenmaal gewassen; (e) geïncubeerd in 3,3′,5,5′-tetramethylbenzidine peroxidase-substraat om een colorimetrische reactie te initiëren die wordt gestopt door toevoeging van 0,09 N H2SO4; en (f) gemeten op absorptie bij 450 nm met behulp van een spectrofotometer.
|
|
| In vivo |
In het GTL-16-model toont PF-2341066 het vermogen om een duidelijke regressie van grote, reeds bestaande tumoren (>600 mm3) te veroorzaken in zowel de 50 mg/kg/dag als de 75 mg/kg/dag behandelingscohorten, met een afname van 60% in het gemiddelde tumorvolume over het 43-daagse toedieningsschema. In een andere studie toont PF-2341066 het vermogen om de tumorgroei van GTL-16 gedurende >3 maanden volledig te remmen, waarbij slechts 1 van de 12 muizen een significante toename van de tumorgroei vertoont over het 3 maanden durende behandelingsschema van 50 mg/kg/dag. In het NCI-H441 NSCLC-model wordt een afname van 43% in het gemiddelde tumorvolume waargenomen bij 50 mg/kg/dag gedurende de 38-daagse PF-2341066-toedieningscyclus. In het Caki-1 RCC-model wordt een afname van 53% in het gemiddelde tumorvolume waargenomen in verband met een afname van het volume van elke tumor met ten minste 30% bij 50 mg/kg/dag gedurende de 33-daagse PF-2341066-toedieningscyclus. PF-2341066 toont ook een bijna volledige preventie van de groei van reeds bestaande tumoren bij 50 mg/kg/dag in de U87MG glioblastoom- of PC-3 prostaatcarcinoom xenograft-modellen, met respectievelijk 97% of 84% remming op de laatste studiedag. Daarentegen remt PF-2341066 oraal toegediend bij 50 mg/kg/dag de tumorgroei in het MDA-MB-231 borstcarcinoommodel of het DLD-1 coloncarcinoommodel niet significant. Een significante dosisafhankelijke reductie van CD31-positieve endotheelcellen wordt waargenomen bij 12,5 mg/kg/dag, 25 mg/kg/dag en 50 mg/kg/dag in GTL-16-tumoren, wat aangeeft dat remming van MVD een dosisafhankelijke correlatie met antitumorale werkzaamheid vertoont. PF-2341066 vertoont een significante dosisafhankelijke reductie van menselijke VEGFA- en IL-8-plasmaspiegels in zowel de GTL-16- als U87MG-modellen. Een duidelijke remming van gefosforyleerde c-Met-, Akt-, Erk-, PLCλ1- en STAT5-spiegels wordt waargenomen in GTL-16-tumoren na orale toediening van PF-2341066.
|
Referenties |
|
Informatie over klinische proeven
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Werving | Aandoeningen | Sponsor/medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT06062810 | Not yet recruiting | Non-Small Cell Lung Cancer |
Han Xu M.D. Ph.D. FAPCR Sponsor-Investigator IRB Chair|Medicine Invention Design Inc |
March 28 2024 | Phase 2|Phase 3 |
| NCT04148066 | Completed | Carcinoma Non-Small-Cell Lung |
The Netherlands Cancer Institute|Roche Pharma AG |
July 17 2019 | Not Applicable |
| NCT03947385 | Recruiting | Metastatic Uveal Melanoma|Cutaneous Melanoma|Colorectal Cancer|Other Solid Tumors |
IDEAYA Biosciences |
June 28 2019 | Phase 1|Phase 2 |
| NCT03672643 | Terminated | ALK or ROS1-positive NSCLC |
Pfizer |
January 28 2019 | Phase 4 |
| NCT03439215 | Unknown status | Carcinoma Non-Small-Cell Lung |
Fondazione Ricerca Traslazionale|Clinical research technology Srl |
June 13 2017 | Phase 2 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, laat dan een bericht achter.
