alleen voor onderzoeksdoeleinden
Alvimopan Opioid Receptor antagonist
Cat.nr.S5935
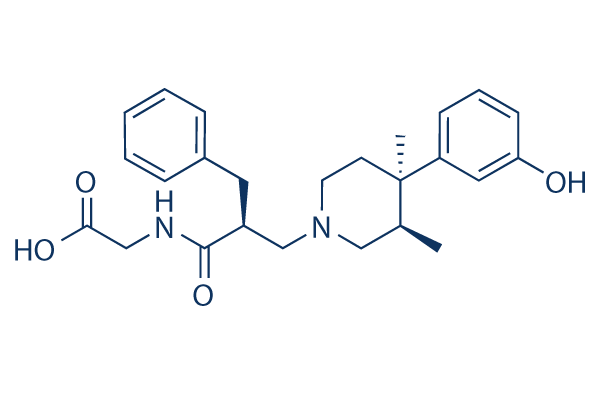
Chemische structuur
Molecuulgewicht: 424.53
Kwaliteitscontrole
| Gerelateerde doelwitten | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Overig Opioid Receptor Inhibitoren | JTC-801 (+)-Matrine Racecadotril Trimebutine Docusate Sodium Trimebutine maleate Asimadoline hydrochloride BMS-986122 Naloxegol Oxalate methylnaltrexone bromide |
Chemische informatie, opslag en stabiliteit
| Molecuulgewicht | 424.53 | Formule | C25H32N2O4 |
Opslag (vanaf de datum van ontvangst) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS-nr. | 156053-89-3 | -- | Opslag van stamoplossingen |
|
|
| Synoniemen | LY 246736, ADL 8-2698 | Smiles | CC1CN(CCC1(C)C2=CC(=CC=C2)O)CC(CC3=CC=CC=C3)C(=O)NCC(=O)O | ||
Oplosbaarheid
|
In vitro |
DMSO
: 85 mg/mL
(200.22 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo formulatiecalculator (heldere oplossing)
Stap 1: Voer onderstaande informatie in (Aanbevolen: een extra dier om rekening te houden met verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in de sectie oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-moedervloeistof: mg geneesmiddel vooropgelost in μL DMSO ( Concentratie moedervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de batch van het geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toeμL PEG300, mengen en verhelderen, daarna toevoegenμL Tween 80, mengen en verhelderen, daarna toevoegen μL ddH2O, mengen en verhelderen.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO moedervloeistof, voeg daarna toe μL Maïsolie, mengen en verhelderen.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysieke methoden zoals vortexen, ultrasoon of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
μ-opioid receptor
(Cell-free assay) 0.77 nM(Ki)
δ-opioid receptor
(Cell-free assay) 4.4 nM
δ-opioid receptor
(Cell-free assay) 4.4 nM(Ki)
κ-opioid receptor
(Cell-free assay) 40 nM(Ki)
|
|---|---|
| In vitro |
Alvimopan is zeer selectief (door ≥227-voudig) voor de menselijke μ-receptor ten opzichte van het κ-subtype, maar heeft een meer bescheiden (≥6-voudig) μ/δ-receptorselectiviteit. In het geïsoleerde ileum van cavia's is deze verbinding een krachtige antagonist van morfine-, DAMGO- of endomorfine-1-geïnduceerde, en μ Opioid Receptor-gemedieerde, remming van elektrisch-opgewekte contracties (pA2-waarden van 9,6 of 9,7). De δ en κ antagonistische potenties van deze chemische stof zijn lager in het cavia-ileum (pA2-waarden van respectievelijk 8,7 en 7,8). Deze verbinding (1 of 10 μM) heeft geen significante affiniteit voor een breed scala aan niet-opioïde receptoren, ionenkanalen en enzymen waarop het is getest. |
| In vivo |
Bij dieren antagoniseert alvimopan centraal gemedieerde, morfine-geïnduceerde analgesie alleen bij relatief hoge doses, waarbij zeer hoge plasmaconcentraties nodig zijn om de bloed-hersenbarrière te passeren. Na intraveneuze toediening is deze verbinding ongeveer 200 keer potenter in het blokkeren van perifere versus centrale μ-receptoren. Na orale toediening is het ook zeer actief. Bij honden zorgde intraveneuze toediening van deze chemische stof voor dosisafhankelijke stijgingen van piekplasmaconcentraties en plasma-oppervlak onder de concentratie-tijdcurve. Als gevolg van slechte systemische absorptie produceerden orale doses tot 100 mg/kg echter lage plasmaconcentraties (gemiddelde Cmax =92,9 ng/ml), wat resulteerde in een orale biologische beschikbaarheid van ongeveer 0,03%. De halfwaardetijd van dit middel wordt geschat op ongeveer 10 minuten na intraveneuze toediening bij honden en konijnen. |
Referenties |
|
Informatie over klinische proeven
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Werving | Aandoeningen | Sponsor/medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT03068975 | Terminated | Post Operative Ileus |
University of Puerto Rico|Merck Sharp & Dohme LLC |
September 1 2017 | Phase 4 |
| NCT00259922 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 2005 | Phase 3 |
| NCT00256932 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 2005 | Phase 3 |
| NCT00241722 | Completed | Bowel Dysfunction|Constipation |
Cubist Pharmaceuticals LLC a subsidiary of Merck & Co. Inc. (Rahway New Jersey USA)|GlaxoSmithKline |
August 1 2005 | Phase 3 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, laat dan een bericht achter.
