réservé à la recherche
XL147 analogue PI3K inhibiteur
N° Cat.S1118
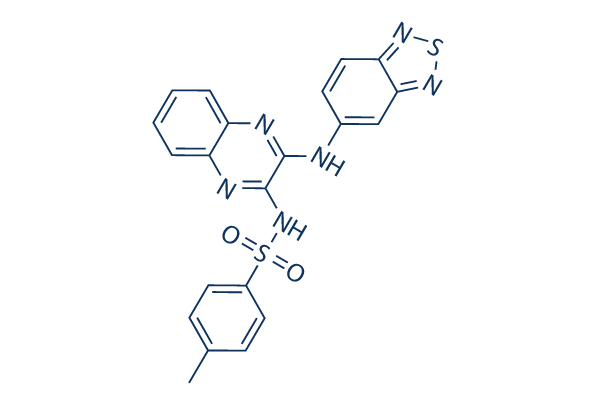
Structure chimique
Poids moléculaire: 448.52
Contrôle qualité
| Cibles apparentées | Akt mTOR GSK-3 ATM/ATR DNA-PK AMPK PDPK1 PTEN PP2A PDK |
|---|---|
| Autre PI3K Inhibiteurs | GDC-0077 (Inavolisib) SAR405 Quercetin (Sophoretin) LY294002 Tersolisib (STX-478) Buparlisib (BKM120) 740 Y-P (PDGFR 740Y-P) GO-203 TFA Eganelisib (IPI-549) Paxalisib (GDC-0084) |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 448.52 | Formule | C21H16N6O2S2 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 956958-53-5 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | SAR245408 | Smiles | CC1=CC=C(C=C1)S(=O)(=O)NC2=NC3=CC=CC=C3N=C2NC4=CC5=NSN=C5C=C4 | ||
Solubilité
|
In vitro |
DMSO
: 3 mg/mL
(6.68 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
PI3Kγ
(Cell-free assay) 23 nM
PI3Kδ
(Cell-free assay) 36 nM
PI3Kα
(Cell-free assay) 39 nM
PI3Kβ
(Cell-free assay) 383 nM
|
|---|---|
| In vitro |
Le XL147 analogue inhibe les isoformes de la classe I de PI3K de manière compétitive à l'ATP. Dans un panel de lignées cellulaires de cancer du sein humain surexprimant HER2, le traitement avec ce composé abroge la phosphorylation d'AKT et de S6, mais induit également l'expression et la phosphorylation de HER3 et d'autres RTK. Dans les cellules HER2+, la phosphorylation de HER3 est maintenue par la tyrosine kinase HER2, ce qui conduit à une récupération partielle d'AKT phosphorylé (pAKT) et limite ainsi l'action antitumorale de cette substance chimique. De plus, le silençage de HER3 ou le traitement avec les agents anti-HER2 trastuzumab ou lapatinib sensibilise les cellules de cancer du sein HER2+ à cet agent in vitro et in vivo. Le traitement avec cet inhibiteur inhibe la croissance en monocouche de toutes les lignées cellulaires testées, y compris BT474, HCC1937 et al., de manière dose-dépendante. L'effet principal de ce composé est l'inhibition de la prolifération cellulaire. Il induit la mort cellulaire à une concentration de 20 μM. Le traitement avec cette substance chimique conduit à une inhibition dose-dépendante de PI3K. Conformément à l'inhibition de la prolifération cellulaire, il induit une réduction de la cycline D1 et de pRB et une augmentation des niveaux de l'inhibiteur de CDK p27KIPI, mais aucun changement détectable dans les niveaux de poly(ADP-ribose) polymérase (PARP) totale ou clivée. Le traitement avec cet agent entraîne une réduction dose-dépendante de pAKTS473/T308 et pS6S240/244. Étonnamment, il déclenche également une surexpression des niveaux totaux de HER3 et/ou de pHER3Y1289. Dans les cellules surexprimant HER2, l'inhibition de PI3K est suivie d'une surexpression de l'expression et de la phosphorylation de plusieurs récepteurs tyrosine kinases, y compris HER3. Le silençage des facteurs de transcription FoxO1 et FoxO3a empêche l'induction des ARNm de HER3, InsR, IGF1R et FGFR2 lors de l'inhibition de PI3K. Dans les cellules HER2+, le silençage de HER3 avec un siRNA ou un cotraitement avec les inhibiteurs de HER2 trastuzumab ou lapatinib améliore la mort cellulaire induite par XL147 et l'inhibition de pAKT et pS6.
|
| In vivo |
Des souris athymiques avec des xénogreffes BT474 sont traitées aléatoirement avec le XL147 analogue, le lapatinib, le trastuzumab, ou ce composé plus chaque antagoniste de HER2. Chaque monothérapie inhibe significativement la croissance tumorale, le trastuzumab étant le seul agent à induire une régression tumorale complète chez une des huit souris. Les deux combinaisons sont supérieures aux médicaments respectifs administrés seuls. Notamment, la combinaison de trastuzumab et de cette substance chimique, mais pas le lapatinib et le XL147, induit une réponse tumorale complète chez trois des huit souris. Aucune toxicité médicamenteuse marquée n'est observée dans aucun des bras de traitement. La combinaison de ce composé plus le trastuzumab prévient pHER3 plus puissamment que n'importe quel autre traitement. En bon accord avec les différences de croissance tumorale entre les bras de traitement, le pAKT nucléaire est plus faible dans les tumeurs traitées avec XL147 plus lapatinib ou cette substance chimique plus trastuzumab par rapport aux tumeurs traitées avec des agents seuls. Parmi les trois médicaments seuls, ce composé est le seul à avoir montré statistiquement une répression des niveaux de pAKT nucléaire. Aucune modification détectable des niveaux de pAKT cytoplasmique n'est observée. L'inhibition combinée de HER2 et de PI3K dans les xénogreffes dépendantes de HER2 est nécessaire pour inhiber au maximum la sortie de signal de la voie PI3K/AKT.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT01943838 | Completed | Neoplasm Malignant |
Sanofi |
October 2013 | Phase 1 |
| NCT01436565 | Completed | Solid Tumor Cancers |
Sanofi|Merrimack Pharmaceuticals |
November 2011 | Phase 1 |
| NCT01392924 | Completed | Neoplasm Malignant |
Sanofi |
August 2011 | Phase 1 |
| NCT01357330 | Completed | Solid Tumors |
Sanofi |
May 2011 | Phase 1 |
| NCT01240460 | Completed | Glioblastoma|Astrocytoma Grade IV |
Sanofi |
January 2011 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
