Technische gegevens
| Formule | C22H27FN4O2 |
||||||
| Moleculair gewicht | 398.47 | CAS-nr. | 557795-19-4 | ||||
| Oplosbaarheid (25°C)* | In vitro | DMSO | 35 mg/mL (87.83 mM) | ||||
| Ethanol | 5 mg/mL (12.54 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Voeg oplosmiddelen afzonderlijk en in volgorde toe aan het product.) |
|
||||||
|
* <1 mg/ml betekent licht oplosbaar of onoplosbaar. * Houd er rekening mee dat Selleck de oplosbaarheid van alle verbindingen intern test en de werkelijke oplosbaarheid enigszins kan afwijken van gepubliceerde waarden. Dit is normaal en is te wijten aan lichte batch-tot-batch variaties. * Verzending op kamertemperatuur (Stabiliteitstests tonen aan dat dit product zonder koelmaatregelen kan worden verzonden.) |
|||||||
Voorbereiden van stamoplossingen
Biologische activiteit
| Beschrijving | Sunitinib is een multi-targeted RTK-remmer die zich richt op VEGFR2 (Flk-1) en PDGFRβ met IC50 van 80 nM en 2 nM, en remt ook c-Kit. Sunitinib is ook een dosisafhankelijke remmer van de autofosforyleringsactiviteit van IRE1α. Sunitinib induceert autophagy en apoptosis. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Doelen |
|
||||||||
| In vitro | Sunitinib remt ook krachtig Kit en FLT-3. Deze verbinding is een potente ATP-competitieve remmer van VEGFR2 (Flk1) en PDGFRβ met Ki van respectievelijk 9 nM en 8 nM, en vertoont een >10-voudige hogere selectiviteit voor VEGFR2 en PDGFR dan voor FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl en src. In serum-gehongerde NIH-3T3 cellen die VEGFR2 of PDGFRβ tot expressie brengen, remt het VEGF-afhankelijke VEGFR2-fosforylering en PDGF-afhankelijke PDGFRβ-fosforylering met een IC50 van respectievelijk 10 nM en 10 nM. Deze chemische stof remt VEGF-geïnduceerde proliferatie van serum-gehongerde HUVEC's met een IC50 van 40 nM, en remt PDGF-geïnduceerde proliferatie van NIH-3T3 cellen die PDGFRβ of PDGFRα overexpresseren met een IC50 van respectievelijk 39 nM en 69 nM. Het remt fosforylering van wild-type FLT3, FLT3-ITD en FLT3-Asp835 met een IC50 van respectievelijk 250 nM, 50 nM en 30 nM. Deze remmer remt de proliferatie van MV4;11 en OC1-AML5 cellen met een IC50 van respectievelijk 8 nM en 14 nM, en induceert apoptosis op een dosisafhankelijke manier. | ||||||||
| In vivo | In overeenstemming met de substantiële en selectieve remming van VEGFR2- of PDGFR-fosforylering en -signalering in vivo, vertoont Sunitinib (20-80 mg/kg/dag) een brede en potente dosisafhankelijke antitumoractiviteit tegen een verscheidenheid aan tumoxenograftmodellen, waaronder HT-29, A431, Colo205, H-460, SF763T, C6, A375 of MDA-MB-435. Deze verbinding, gedoseerd met 80 mg/kg/dag gedurende 21 dagen, leidt tot volledige tumorregressie bij zes van de acht muizen, zonder tumorhergroei gedurende een observatieperiode van 110 dagen na het einde van de behandeling. Een tweede behandelronde met deze verbinding blijft werkzaam tegen tumoren die niet volledig zijn geregresseerd tijdens de eerste behandelronde. De behandeling met deze verbinding resulteert in een significante afname van tumor-MVD, met ~40% reductie in SF763T-glioomtumoren. SU11248-behandeling resulteert in een volledige remming van verdere tumorgroei van luciferine-expresserende PC-3M-xenografts, ondanks geen reductie in tumoromvang. Deze verbinding (20 mg/kg/dag) onderdrukt dramatisch de groei van subcutane MV4;11 (FLT3-ITD) xenografts en verlengt de overleving in het FLT3-ITD beenmergtransplantatiemodel. |
Protocol (uit referentie)
| Kinase-assay: |
|
|---|---|
| Celassay: |
|
| Dierstudie: |
|
Referenties
|
Klantproductvalidatie
-
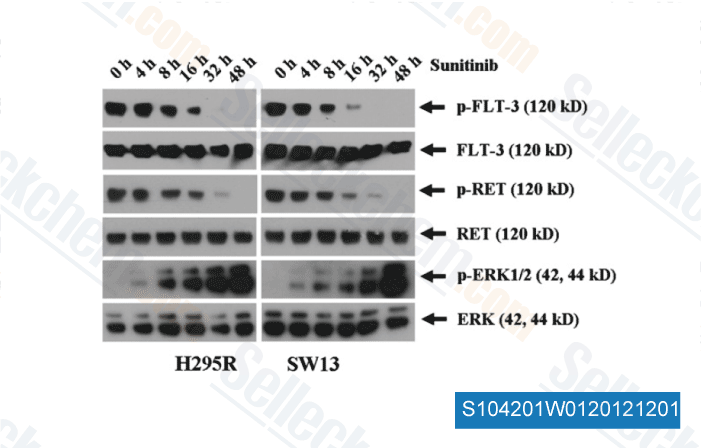
Gegevens van [ Surgery , 2012 , 152, 1045-50 ]
-
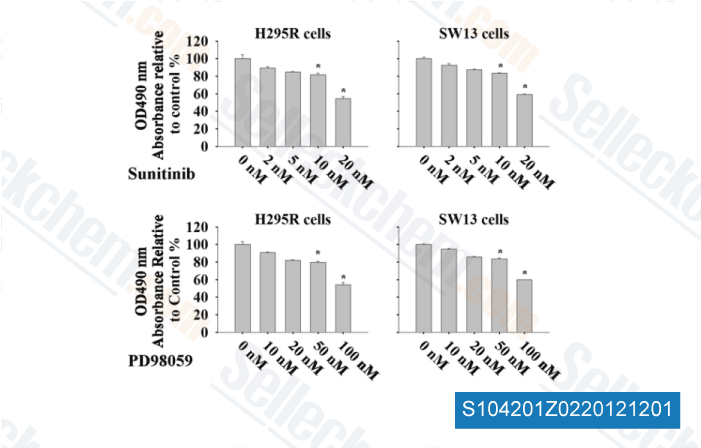
Gegevens van [ Surgery , 2012 , 152, 1045-50 ]
-
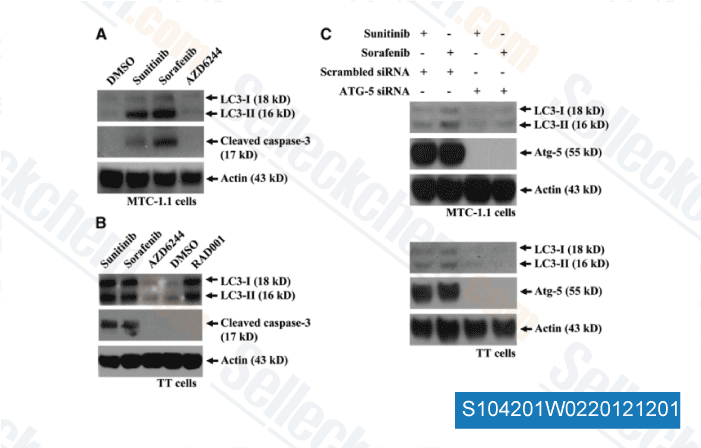
Gegevens van [ Surgery , 2012 , 152, 1142-9 ]
-
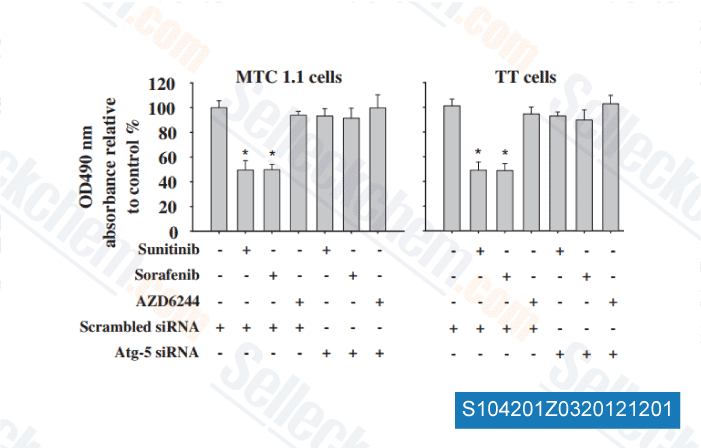
Gegevens van [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU-11248) Is geciteerd door 257 Publicaties
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Single-cell multi-omics reveals that FABP1 + renal cell carcinoma drive tumor angiogenesis through the PLG-PLAT axis under fatty acid reprogramming [ Mol Cancer, 2025, 24(1):179] | PubMed: 40518526 |
| Multi-layer stratified oncology platform utilizing transcriptomics, prostate cancer organoids, and modeling of drug response [ J Exp Clin Cancer Res, 2025, 44(1):290] | PubMed: 41094672 |
| O-GlcNAcylation of UBAP2L regulates stress granule formation and sunitinib resistance in clear cell renal cell carcinoma [ J Exp Clin Cancer Res, 2025, 44(1):273] | PubMed: 41029457 |
| The novel hydrogen-PT2385-silncARSR nanocomplex impairs tumor angiogenesis and mitochondrial activity in sunitinib-resistant renal cancer [ Mater Today Bio, 2025, 35:102450] | PubMed: 41235366 |
| Unveiling the Anti-Angiogenic Potential of Small-Molecule (Kinase) Inhibitors for Application in Rheumatoid Arthritis [ Cells, 2025, 14(2)102] | PubMed: 39851530 |
| Baicalin reduces sunitinib-induced cardiotoxicity in renal carcinoma PDX model by inhibiting myocardial injury, apoptosis and fibrosis [ Front Pharmacol, 2025, 16:1563194] | PubMed: 40264678 |
| Kinomic profiling to predict sunitinib response of patients with metastasized clear cell Renal Cell Carcinoma [ Neoplasia, 2025, 60:101108] | PubMed: 39724752 |
| CYP1B1 promotes angiogenesis and sunitinib resistance in clear cell renal cell carcinoma via USP5-mediated HIF2α deubiquitination [ Neoplasia, 2025, 66:101186] | PubMed: 40435846 |
| Hyperpolarized [1-13C]pyruvate NMR spectroscopy reveals transition of tumor energy metabolism in microscale multicellular spheroids [ Sci Rep, 2025, 15(1):19303] | PubMed: 40456829 |
RETOURBELEID
Selleck Chemicals onvoorwaardelijke retourbeleid zorgt voor een soepele online winkelervaring voor onze klanten. Als u op enigerlei wijze ontevreden bent met uw aankoop, kunt u elk artikel(en) binnen 7 dagen na ontvangst retourneren. In geval van problemen met de productkwaliteit, zowel protocolgerelateerde als productgerelateerde problemen, kunt u elk artikel(en) binnen 365 dagen na de oorspronkelijke aankoopdatum retourneren. Volg de onderstaande instructies bij het retourneren van producten.
VERZENDING EN OPSLAG
Selleck producten worden bij kamertemperatuur vervoerd. Als u het product op kamertemperatuur ontvangt, wees dan gerust, de Selleck kwaliteitsinspectieafdeling heeft experimenten uitgevoerd om te controleren of de normale temperatuurplaatsing van één maand de biologische activiteit van poederproducten niet beïnvloedt. Na ontvangst dient u het product op te slaan volgens de vereisten beschreven in het gegevensblad. De meeste Selleck producten zijn stabiel onder de aanbevolen omstandigheden.
NIET VOOR HUMANE, VETERINAIRE DIAGNOSTISCHE OF THERAPEUTISCHE DOELEINDEN.
