Technische gegevens
| Formule | C25H26ClN5O3 |
||||||
| Moleculair gewicht | 479.96 | CAS-nr. | 468740-43-4 | ||||
| Oplosbaarheid (25°C)* | In vitro | DMSO | 96 mg/mL (200.01 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Voeg oplosmiddelen afzonderlijk en in volgorde toe aan het product.) |
|
||||||
|
* <1 mg/ml betekent licht oplosbaar of onoplosbaar. * Houd er rekening mee dat Selleck de oplosbaarheid van alle verbindingen intern test en de werkelijke oplosbaarheid enigszins kan afwijken van gepubliceerde waarden. Dit is normaal en is te wijten aan lichte batch-tot-batch variaties. * Verzending op kamertemperatuur (Stabiliteitstests tonen aan dat dit product zonder koelmaatregelen kan worden verzonden.) |
|||||||
Voorbereiden van stamoplossingen
Biologische activiteit
| Beschrijving | BMS-536924 (CS-0117) is een ATP-competitieve IGF-1R/IR-remmer met een IC50 van 100 nM/73 nM, bescheiden activiteit voor Mek, Fak en Lck met zeer weinig activiteit voor Akt1, MAPK1/2. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Doelen |
|
|||||||||||
| In vitro | BMS-536924 remt ook FAK en Lck met IC50 van respectievelijk 150 nM en 341 nM. Deze verbinding remt cellulaire proliferatie en verstoort de Akt- en MAPK-fosforylatie. Het remt IGF-I-gestimuleerde IGF-1R-signalering in MCF10A-cellen en blokkeert constitutieve IGF-1R-activiteit in CD8-IGF-1R-MCF10A. Voorincubatie van MCF10A-cellen met 1 μM van deze chemische stof blokkeert volledig het vermogen van IGF-I om IGF-1R-fosforylatie te stimuleren. IGF-I-stimulatie resulteert in verhoogde fosforylatie van ERK1/2, GSK3β en Akt. Deze verbinding remt deze ligand-geïnduceerde fosforylatie. Behandeling van de CD8-IGF-1R-MCF10A-cellen met deze remmer resulteert in een dosisafhankelijke remming van fosforylatie met gedeeltelijke remming bij 0,01 μM en 0,1 μM, maar volledige receptorremming bij een concentratie van 1 μM. Maximale remming van gefosforyleerd IGF-1R wordt al 10 minuten na incubatie waargenomen. Het behoudt zijn vermogen om IGF-1R-fosforylatie tot 48 uur te remmen. Toevoeging van dit middel remt Akt-fosforylatie tijdsafhankelijk vanaf 1 uur. Na 48 uur is Akt-activatie volledig geblokkeerd. Behandeling met deze verbinding vertoont antiproliferatieve activiteit in een panel van kankercellijnen, waaronder TC32, HT1080/S, SK-LMS-1, H513 en CTR-cellen. pIGF-1R/pIR wordt geactiveerd na IGF-I/insuline-stimulatie en de activering wordt geremd door deze chemische stof met vergelijkbare potenties in Rh41- en Rh36-cellijnen. De expressie van geprogrammeerde celdood 4 (PDCD4), splitsing van poly(ADP-ribose) polymerase (PARP) en caspase-3 zijn opgereguleerd in Rh41-cellen behandeld met deze remmer. | |||||||||||
| In vivo | Orale toediening van BMS-536924 bij 100-300 mpk remt het IGR-1R Sal tumormodel sterk. Werkzaamheid wordt ook waargenomen in het niet-gemodificeerde Colo205 menselijk coloncarcinoommodel. Orale toediening van deze verbinding volgens een eenmaal daags schema (100-300 mpk) of een tweemaal daags schema (50, 100 mpk) toont antitumoractiviteit in dit tumormodel. De orale glucosetolerantietest (OGTT) toont aan dat 100 mpk (b.i.d.) een significante verhoging van de glucosespiegels veroorzaakt na glucosetoediening. De farmacokinetische parameters van deze chemische stof, oraal toegediend in poly(ethyleenglycol) 400 en water (80:20 v/v), worden bepaald bij muizen, ratten, honden en apen. Een goede biologische beschikbaarheid is duidelijk bij alle soorten. Significante niet-lineaire farmacokinetiek wordt waargenomen bij knaagdieren bij toenemende p.o.-dosis. Deze verbinding vermindert het volume van tumorxenografts van CD8-IGF-1R-MCF10A-cellen na twee weken behandeling (100 mg/kg) tot 76%. Orale toediening van 70 mg/kg van deze chemische stof remt significant de tumorgroei (TGBC-1TKB-cellen) geïnoculeerd in naaktmuizen. Het reguleert apoptose in xenografttumoren opwaarts. De behandeling heeft geen nadelige effecten op het lichaamsgewicht van muizen of de glucosespiegels op het moment van overlijden, wat duidt op een verdraagbare toxiciteit. |
Protocol (uit referentie)
| Kinase-assay: |
|
|---|---|
| Celassay: |
|
| Dierstudie: |
|
Referenties
|
Klantproductvalidatie
-
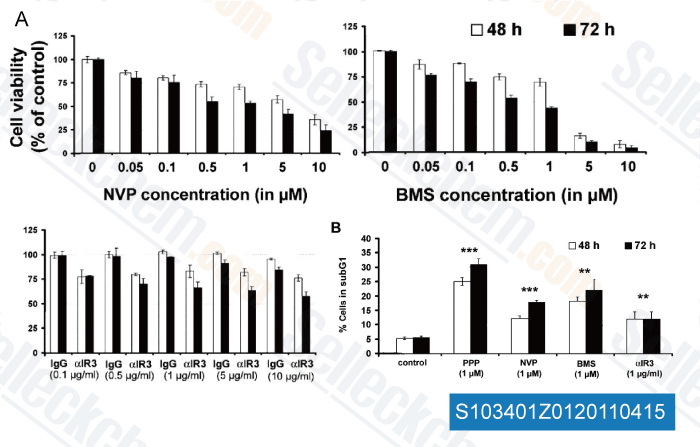
Gegevens van [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
-
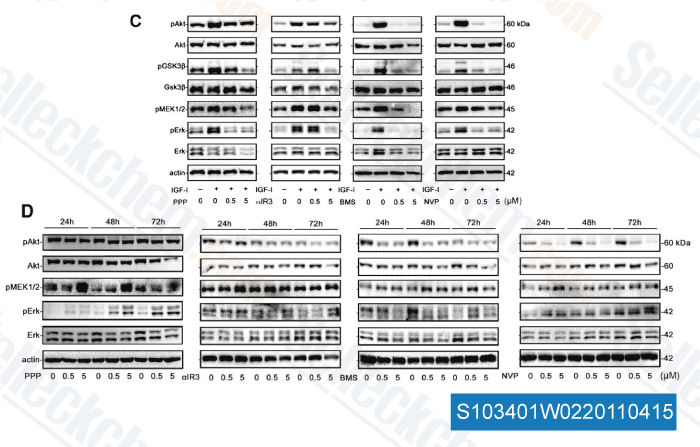
Gegevens van [ Clin Cancer Res , 2011 , 17, 2237-2249 ]
-
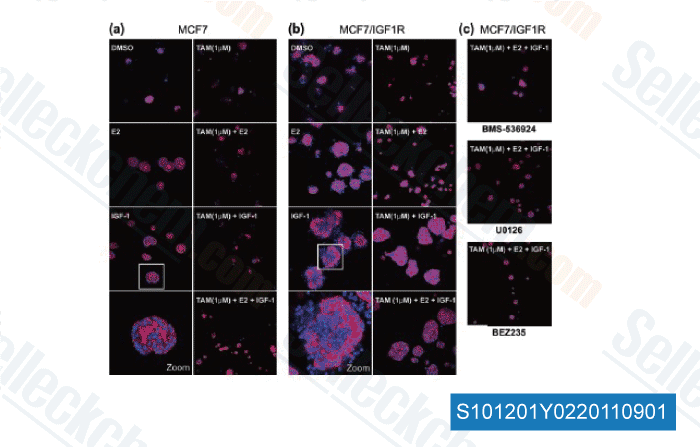
Gegevens van [ Breast Cancer Res , 2011 , 13, R52 ]
-
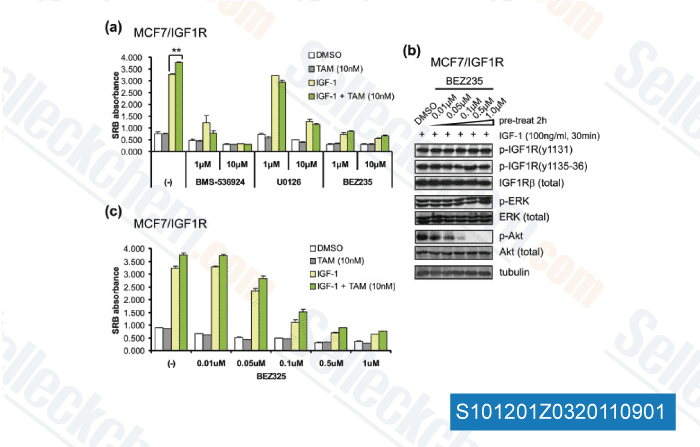
Gegevens van [ Breast Cancer Res , 2011 , 13, R52 ]
Sellecks BMS-536924 Is geciteerd door 27 Publicaties
| Haploinsufficiency of miR-143 and miR-145 reveal targetable dependencies in resistant del(5q) myelodysplastic neoplasm [ Leukemia, 2025, 39(4):917-928] | PubMed: 40000845 |
| Inhibition of Selenoprotein I promotes ferroptosis and reverses resistance to platinum chemotherapy by impairing Akt phosphorylation in ovarian cancer [ MedComm (2020), 2024, 5(12):e70033] | PubMed: 39669976 |
| High-Content and High-Throughput Clonogenic Survival Assay Using Fluorescence Barcoding [ Cancers -Basel), 2023, 15(19)4772] | PubMed: 37835466 |
| SFRP4+ stromal cell subpopulation with IGF1 signaling in human endometrial regeneration [ Cell Discov, 2022, 8(1):95] | PubMed: 36163341 |
| Multi-omics characterization of autophagy-related molecular features for therapeutic targeting of autophagy [ Nat Commun, 2022, 13(1):6345] | PubMed: 36289218 |
| FER-mediated phosphorylation and PIK3R2 recruitment on IRS4 promotes AKT activation and tumorigenesis in ovarian cancer cells [ Elife, 2022, 11e76183] | PubMed: 35550247 |
| Exosomes from cisplatin-induced dormant cancer cells facilitate the formation of premetastatic niche in bone marrow through activating glycolysis of BMSCs [ Front Oncol, 2022, 12:922465] | PubMed: 36568212 |
| Intermittent parathyroid hormone improves orthodontic retention via insulin-like growth factor-1 [ Oral Dis, 2021, 27(2):290-300] | PubMed: 32608117 |
| Manganese Acts upon Insulin/IGF Receptors to Phosphorylate AKT and Increase Glucose Uptake in Huntington's Disease Cells [ Mol Neurobiol, 2020, 57(3):1570-1593] | PubMed: 31797328 |
| Loss of N-Glycanase 1 Alters Transcriptional and Translational Regulation in K562 Cell Lines [ G3 (Bethesda), 2020, 4;10(5):1585-1597] | PubMed: 32265286 |
RETOURBELEID
Selleck Chemicals onvoorwaardelijke retourbeleid zorgt voor een soepele online winkelervaring voor onze klanten. Als u op enigerlei wijze ontevreden bent met uw aankoop, kunt u elk artikel(en) binnen 7 dagen na ontvangst retourneren. In geval van problemen met de productkwaliteit, zowel protocolgerelateerde als productgerelateerde problemen, kunt u elk artikel(en) binnen 365 dagen na de oorspronkelijke aankoopdatum retourneren. Volg de onderstaande instructies bij het retourneren van producten.
VERZENDING EN OPSLAG
Selleck producten worden bij kamertemperatuur vervoerd. Als u het product op kamertemperatuur ontvangt, wees dan gerust, de Selleck kwaliteitsinspectieafdeling heeft experimenten uitgevoerd om te controleren of de normale temperatuurplaatsing van één maand de biologische activiteit van poederproducten niet beïnvloedt. Na ontvangst dient u het product op te slaan volgens de vereisten beschreven in het gegevensblad. De meeste Selleck producten zijn stabiel onder de aanbevolen omstandigheden.
NIET VOOR HUMANE, VETERINAIRE DIAGNOSTISCHE OF THERAPEUTISCHE DOELEINDEN.
